Nobelpreise 2012: Zurück auf "Los!"
Noch vor wenigen Jahren hatten Biologen kaum Zweifel: Eine Hautzelle ist eine Hautzelle – und bleibt es, bis sie stirbt. Genauso werden aus ausgewachsenen Muskelzellen nie Darmwandzellen oder umgekehrt: Das unausgesprochene Dogma des für immer festgezurrten zellulären Lebenslaufs legte fest, dass Zellen, die einmal spezialisierte Funktionen im Körper übernommen haben, dann für immer auf nur diesen Beruf eingeschworen sind. Mit der Spezialisierung gäben sie stets auch die Fähigkeit auf, in ihren nach allen Seiten offenen Urzustand zurückzukehren, also wieder "pluripotent" zu werden – zu einer Zelle, die zur Haut-, Muskel- oder Darmzelle werden kann. Die Nobellaureaten 2012, der Brite Sir John B. Gurdon und der Japaner Shinya Yamanaka, erhalten nun die höchste Auszeichnung der Wissenschaft auch für den Mut, mit Experimenten gegen den Strom geschwommen zu sein und dieses Dogma schließlich gekippt zu haben. Der Forschung eröffnete das völlig neue und unverhoffte Perspektiven.
Zwischen den preiswürdigen wichtigsten Veröffentlichungen der beiden Wissenschaftler liegen vier lange Jahrzehnte. Bereits 1962 hatte Gurdon – heute im Alter von 79 Jahren am nach ihm selbst benannten Gurdon College der University of Cambridge – unerhörte Ergebnisse nach seinen Versuchen mit Froscheiern vorzuweisen. Sie schienen unglaublicherweise zu belegen, dass die Kerne ausdifferenzierter Zellen von Kaulquappen durchaus radikal rückprogrammierbar sind: Transplantiert man sie in eine entkernte Eizelle, so wächst das entstehende Konstrukt zwar selten, manchmal aber eben doch zu einer quicklebendigen Kaulquappe heran [1]. Die transplantierten spezialisierten Kerne müssen sich irgendwie in pluripotente Alleskönner zurückverwandelt haben, die zum Vorläufer aller Körperzellen taugen und zudem das ganze Entwicklungsgeschehen dirigieren können.
Es dauerte viele Jahre, bis die Fachwelt die Ergebnisse von Gurdon oft genug reproduziert hatte, um sie nicht länger ernsthaft anzweifeln zu können. Am Ende gipfelte die von einigen anderen Laboren aufgenommene Forschung und Verfeinerung von Gurdons Orginaltechnik, dem "somatischen Zellkerntransfer", schließlich in einem spektakulären wissenschaftlichen Paukenschlag, dem ersten geklonten Tier: Das 1997 im Labor von Ian Wilmut erzeugte Schaf Dolly entstand im Wesentlichen nach demselben Prozedere wie die Kaulquappen Gurdons ein Vierteljahrhundert zuvor. Pionier Gurdon hatte es dabei nur methodisch etwas leichter gehabt als seine Nachfolger, weil er mit Bedacht die großen, übersichtlichen und auch außerhalb eines Uterus wachsenden Froschembryonen zum Forschungsgegenstand gewählt hatte.
Erwachsene, ausdifferenzierte Zellen galten dank Gurdon und seiner Nachfolger nun als im Prinzip reprogrammierbar – was aber genau während dieses Prozesses in ihnen vorgeht, blieb völlig mysteriös. Überhaupt schien die Reprogrammierung der transplantierten Zellkerne weniger durch den Spenderkern als vielmehr durch irgendwelche Faktoren im Milieu der Empfänger-Eizelle ausgelöst zu werden. Dass eine ausgewachsene Zelle sich selbst ohne jeden Zellkerntransfer wieder pluripotent machen kann, blieb mindestens sehr fragwürdig – bis, vor sechs Jahren, schließlich Shinya Yamanaka von der Universität Kioto seine nobelpreiswürdigen Resultate beisteuerte.
Ursprünglich war der heute 50-jährige Yamanaka auf der Suche nach Faktoren gewesen, die eine embryonale pluripotente Stammzelle in ihrem Zustand verharren lässt. Nachdem dann einige solcher Faktoren, verschiedene so genannte Transkriptionsfaktoren, entdeckt waren, wechselte er die Forschungsrichtung: Könnte es nicht sein, dass diese Faktoren auch in ausdifferenzierten Zellen wirksam sind? Könnte es sein, dass sie nicht nur Stammzellen Stammzellen bleiben lassen, sondern vielmehr sogar ausgereifte Zellen wieder in Stammzellen zurückverwandeln?
Yamanaka begann mit 24 Genen, die für verschiedene Transkriptionsfaktoren kodieren, und schleuste sie in die Fibroblasten von Mäuseembryonen ein, die ihm als ausdifferenzierte Versuchszellen dienten. Mit Erfolg: Tatsächlich gelang es ihm schließlich, diese Zellen in pluripotente, ziemlich stammzellähnliche Exemplare zu konvertieren. Nach und nach fand er heraus, dass gerade einmal vier Transkriptionsfaktoren (Myc, Oct3/4, Sox2 und Klf4) ausreichten, solche "induzierten pluripotenten Stammzellen" (ipSC) herzustellen [2].
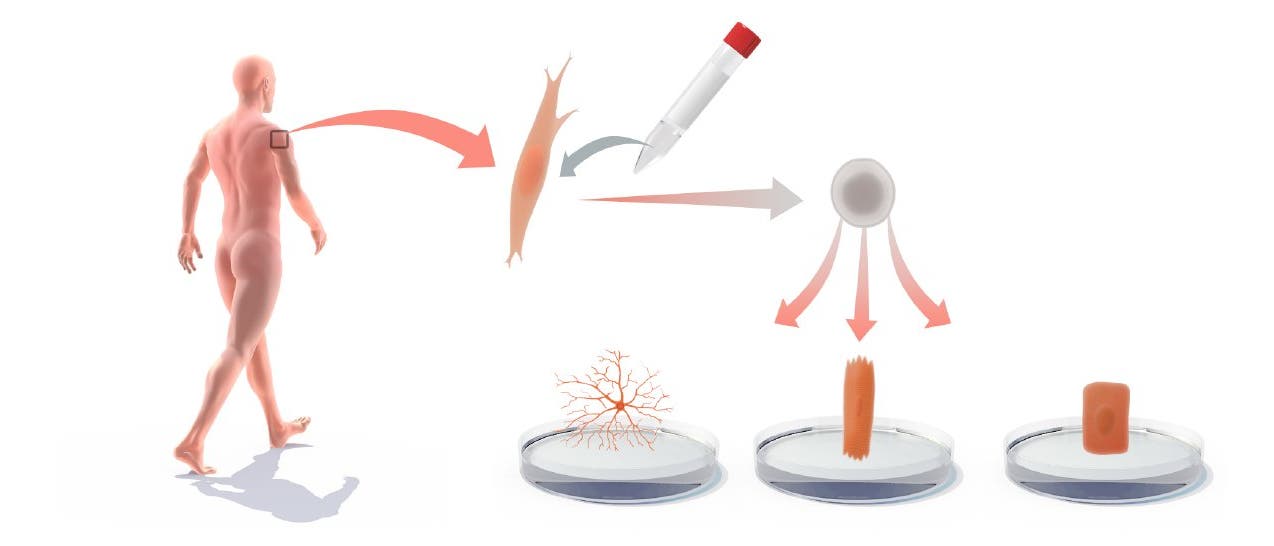
Mittlerweile haben Forscherteams weltweit die Resultate erweitert und verfeinert: Die Zahl der notwendigen Faktoren sank weiter, und es gelang, viele unterschiedliche Zelltypen zu IpS-Zellen zu machen. Zudem können Forscher nun "transdifferenzieren", also Zellen eines Typs – etwa mesodermale Fibroblasten – ohne Umweg über die pluripotente Stammzelle in Zellen eines ganz anderen Typs – etwa in ektodermale Neurone – verwandeln.
Wie oft in der biomedizinischen Forschung entwickeln sich die Dinge rasend schnell, nachdem ein lange gültiges Dogma endlich gekippt ist und der frische Blick auf neue Möglichkeiten frei wird. Das Nobelpreiskomitee trug der Tragweite der neuen Erkenntnis und der Rasanz der Entwicklung Rechnung, indem es Yamanaka bereits sechs Jahre nach seiner bahnbrechenden Veröffentlichung würdigt – Gurdon musste, zugegeben, etwas länger warten. Trotzdem – oder deshalb? – wird es noch einige Zeit dauern, bis die kleine Revolution aus der Grundlagenforschung auch die klinische Forschung aufmischt; bis also zum Beispiel Parkinsonpatienten oder Diabetiker direkt davon profitieren, dass im Prinzip jede differenzierte Zelle zu einer pluripotenten gemacht werden kann. Denkbar ist etwa, die Zellen eines Patienten zu entnehmen, zu gentherapieren, in pluripotente Stammzellen zu verwandeln und aus ihnen vom Immunsystem nicht als fremd erkannte, also auch nicht abgestoßene Reparaturzellen für defekte Gewebe zu züchten.
Das bleibt vorerst Theorie – auch weil zum Beispiel noch daran gearbeitet wird, auszuschließen, dass die veränderten Zellen leichter als andere Körperzellen entarten und Krebs auslösen. In der Praxis dienen Kulturen von ipS-Zellen aus Patienten aber heute schon etwa als Petrischalen-Modellorganismus: Hier kann besser als im lebenden Organismus zellulär nachvollzogen werden, was einer Erkrankung wie der amyotrophischen Lateralsklerose, dem Rett-Syndrom oder der Muskelatrophie zu Grunde liegt.
Solche Fortschritte freuen auch den Preisträger Yamanaka, wie in einem der ersten Interviews nach der Preisverleihung deutlich wird. Mehr noch als der Biologie, so der Japaner, wolle er mit seine Forschung den Patienten dienen. Denn schließlich erinnere er sich noch gut daran, dass er seine Karriere nicht als Laborbiologe, sondern in der medizinischen Klinik als Chirurg begonnen hat – allerdings, so Yamanaka, "als unbegabter". Das passt am Ende gut zu den Anfängen von Sir Gurdon, dem zweiten Preisträger, der dem Vernehmen nach noch heute die Einschätzung seines Biologielehrers im Eton-College in Ehren hält. Dieser hatte Schüler Gurdon einst wie folgt charakterisiert: "Überlegt sich, Wissenschaftler zu werden. Ziemlich lächerlich angesichts seiner derzeitigen Leistungen." Gurdon und Yamanaka zeichnet offenbar aus, immer ihren eigenen Kopf gehabt zu haben.

Schreiben Sie uns!
Beitrag schreiben